您现在的位置是: 首页 > 市场趋势 市场趋势
汽车安全气囊化学原理,汽车安全气囊化学反应
tamoadmin 2024-05-20 人已围观
简介NaN3 + NH4NO3 ------->N2 + Na + N2O + H2O(g) 基本化学原理: 汽车的安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊。[叠氮化钠分解产生氮气和固态钠;硝酸铵分解产生大量的一氧化二氮(N2O)气体和水蒸气]反应中NaN3中N元素化合价升高,被氧化,KN
NaN3 + NH4NO3 ------->N2 + Na + N2O + H2O(g)
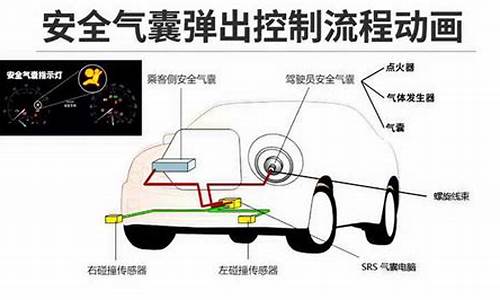
基本化学原理:
汽车的安全气囊内有叠氮酸钠(NaN3)或硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊。[叠氮化钠分解产生氮气和固态钠;硝酸铵分解产生大量的一氧化二氮(N2O)气体和水蒸气]
反应中NaN3中N元素化合价升高,被氧化,KNO3中N元素化合价降低,被还原,根据反应方程式可知,每当生成16molN2,则氧化产物比还原产物多14mol,转移电子的物质的量为10mol,被氧化的N原子的物质的量为30mol,有2molKNO3被还原,现氧化产物比还原产物多1.75mol,则生成2molN2,
A.生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;
B.由反应可知,被还原的硝酸钾的物质的量为2mol×
| 2 |
| 16 |
C.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故C错误;
D.转移10mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为
| 1.25×30 |
| 10 |
故选D.